转自:中华实用儿科临床杂志, 2018,33(19) : 1512-1514. DOI: 10.3760/cma.j.issn.2095-428X.2018.19.015
摘要
营养治疗在儿童炎症性肠病(inflammatory bowel disease,IBD)中的治疗和随访管理中占重要地位。特定碳水化合物饮食(specific carbohydrate diet,SCD)在1951年提出,是一种比较严格的针对碳水化合物种类的饮食限制:只允许摄入单糖类碳水化合物,去除双糖和大多数的多糖、淀粉等复杂碳水化合物,但不限制蛋白质和脂肪的摄入,并适当减少经过加工的肉类或其他加工食品。目前SCD治疗IBD机制尚未完全阐明。理论假设在于:(1)IBD患者肠道发生炎症后会引起双糖酶功能的降低,因此只能吸收葡萄糖、半乳糖和果糖。(2)IBD发生发展与肠道菌群紊乱有关,改变饮食结构能调整肠道菌群,可能有助于改善IBD症状。已有来自回顾性的病例研究和个案报道初步提示SCD改善儿童IBD症状和维持缓解的临床有效性,但目前尚缺乏高质量的循证医学证据支持。SCD中对于碳水化合物摄入的限制,为指导IBD患儿的饮食提供了参考。但是具体执行需要根据当地饮食习惯和常见食品进行食谱的设计,同时兼顾儿童生长发育的需求。
肠内营养在儿童炎症性肠病(inflammatory bowel disease,IBD)中的治疗和随访管理中占重要地位[1]。饮食因素本身也在儿童IBD的发生、发展等多个环节发挥重要作用[2,3]。目前指南已经肯定了全肠内营养(exclusive enteral nutrition,EEN)是儿童轻中度克罗恩病(Crohn′s disease,CD)诱导缓解的首选方案,其具有等同于激素的良好缓解效果,同时能够改善患儿营养状况,减少药物的使用,促进黏膜修复[4]。但长期的肠内营养治疗依从性较差,医疗成本高及维持缓解阶段儿童饮食的特殊性等问题,亟须探索更加实用的饮食方案。目前随着肠道微生态研究的深入,各种IBD饮食治疗方法正处于积极的研究当中。初步的一些个案报道、回顾性研究及病例对照研究提示了某些饮食治疗手段对于临床症状改善的益处。现将目前研究有一定临床有效性的特定碳水化合物饮食(specific carbohydrate diet,SCD)在儿童IBD中的作用进行综述。
1 SCD
1.1 SCD的概念
SCD最开始是由Sidney Haas在1951提出,之后被生化学家Elaine Gottschall在他的著作《Breaking the Vicious Cycle:Intestinal Health Through Diet》当中被详细描述和推广[5]。目前国内尚无统一的译名,根据其对饮食的特殊要求,暂且翻译为”特定碳水化合物饮食”。
SCD规定能够进食的食物主要基于碳水化合物的分子结构,并不是指”低”碳水化合物,而是一种比较严格的针对碳水化合物种类的饮食限制:只允许摄入单糖类碳水化合物,去除双糖和大多数的多糖、淀粉等复杂碳水化合物。因此能够摄入水果、某些富含直链淀粉的蔬菜、坚果、蜂蜜和酸奶,不能摄入谷类、乳糖、蔗糖、麦芽糖等。但是并不限制蛋白质和脂肪的摄入,如肉类、鸡蛋、家禽、鱼类、黄油和油类。但应当适当减少经过加工的肉类或其他加工食品。SCD首先从容易耐受的食物开始,如煮熟、去皮、去籽的水果或蔬菜,然后再慢慢地增加食物的种类,丰富饮食。
1.2 SCD的作用机制
目前SCD的机制尚未完全阐明。SCD最初被提出的假设在于:(1)IBD患者肠道发生炎症后会引起双糖酶功能的降低,因此只能吸收单糖、半乳糖和果糖。(2)IBD的发生发展与肠道菌群紊乱有关,推测改变饮食结构,调整肠道菌群可能有助于改善IBD症状。前期研究推测,多糖和不易消化的复杂碳水化合物吸收差,滞留在结肠中发酵,产生酸、炎性介质、毒素等物质,引起腹泻及引起肠道菌群的紊乱,如肠道细菌过度生长,从而进一步加重IBD的肠道炎症和小肠损伤及引起酶活性的降低。在去除这些碳水化合物之后,可以促进肠道有益菌的生长,调整肠道菌群,改善症状。
SCD对肠道菌群的改变和多样性的增加得到了进一步的研究[6,7]。将使用SCD的10例成人IBD患者粪便菌群[SCD平均使用时间(5.4±5.9)年(0.67~18.20年)]与未使用SCD的8例IBD患者比较,聚类分析(principal coordinates analysis,PCO)结果提示2例患者的肠道菌群与其他人的差异非常明显。而亚组分析提示使用SCD的溃疡性结肠炎(UC)患者的肠道菌群差异比对照组更加明显。这是否提示UC患者使用SCD的效果更加明显?1例合并原发性硬化性胆管炎和溃疡性结肠炎的成人在使用SCD 1周后症状得到明显改善,2周后粪便16srRNA高通量测序结果提示其肠道菌群发生了实质性的改变,其中溃疡梭菌属(Fusobacterium ulcerans)降低了2~3倍,尽管菌群的丰度仍然偏低,但菌群的多样性和均衡性已趋于正常对照[8]。同时,来自于成人的个案报道提示SCD在改善成人IBD,特别是UC患者临床症状的有效性:Susan[9]报道1例33岁的女性患者,UC病史超过13年,药物治疗效果差,并产生了英夫利昔单抗的抗体。在使用6-巯基嘌呤和阿达木单抗的同时接受SCD的饮食,1周后症状有了明显改善,使用SCD 1年后,免疫抑制剂减量,并得到了完全缓解。Khandalavala和Nirmalraj[10]报道1例73岁的老年UC患者,病情在长期缓解后复发,复发后患者将其饮食改变为严格的SCD,使用3~6个月后病情缓解,一般情况得到改善,2年后内镜和病检结果提示UC完全缓解。此后,如果他偶尔进食非SCD,会出现急性症状,但是停止食用后症状能在几天内得到改善。来自于临床的个案报道能够提示SCD对UC临床症状改善的有效性,但对于SCD所致肠道菌群改变在IBD中的作用,还需要更大的样本,甚至包括儿童粪便样本的分析,才能最终得出结论。
2 SCD在儿童IBD中的应用
总体来说,目前尚缺乏高质量的循证医学证据支持SCD在儿童IBD中的作用,已有的研究数据主要来自回顾性的病例研究和个案报道。一项系统性综述纳入的均为观察性研究,合并结果提示SCD作为一种CD治疗的辅助手段,能够得到临床效益[11]。SCD最开始被儿科医师运用主要针对乳糜性疾病[12],之后才将其扩展到UC的治疗。目前病例数最多的临床研究报道[13],纳入了50例处在缓解期的IBD患儿,其中包括了<18岁患儿9例(8例CD患儿,1例ID患儿),儿童IBD患者中,仅有2例使用美沙拉嗪,1例使用甲氨蝶呤。SCD使用后症状改善的平均时间为29.2 d,SCD提高了所有IBD患者的生活质量,66%的患者症状完全消失,并且平均持续9.9个月,SCD控制急性发作的症状有效率为91.3%,维持缓解有效率为92.1%,但坚持SCD的困难度为40%。虽然没有对儿童IBD患儿进行亚组分析,但是初步提示SCD饮食可能是IBD治疗手段之一。
在儿童IBD患者中的回顾性研究:26例儿童IBD患者(CD 20例,UC 6例)与10例对照组患儿,以儿童CD活动指数评分(Pediatric Crohn′s Disease Activity Index,PCDAI)、C反应蛋白和粪便钙卫蛋白作为评价指标,所有儿童在进行SCD饮食后能够有效地维持缓解,甚至某些患儿逐渐停药[14]。Suskind等[15]回顾分析了7例未使用免疫抑制剂的CD患儿[7~16(11.3±3.0)岁,3例未使用早期肠内营养(EEN),2例在使用EEN之后,2例在美沙拉嗪治疗后无明显缓解]在接受SCD饮食后的效果:SCD饮食的时间5~30个月[平均(14.6 ±10.8)个月],所有临床症状在治疗3个月时均得到了改善,并且在整个随访期间无复发,体质量和身高也在增长,且生长速度在正常范围,每位患儿的实验室指标也得到了改善。作者认为SCD和其他低复杂碳水化合物饮食可能是CD患儿的治疗手段。但需要前瞻性研究来肯定其安全性和有效性。
尽管现有一些小样本量的研究提示了SCD对于改善临床症状和炎性指标的正向作用。但仍有学者质疑:由于SCD限制了需要食物种类,可能会影响总体能量的摄入,可能导致一些营养素摄入的缺乏。Braly等[16]对使用SCD的8例IBD患儿进行了营养素摄入的评估,发现SCD能够满足儿童生长发育所需要的每日推荐的营养素供给量(recommended daily allowance,RDA),但是维生素D和钙的摄入是不足的。Burgis等[17]回顾性比较了儿童CD患者严格的SCD和自由的碳水化合物饮食的差异。研究仅纳入了11例CD患儿,年龄6.6~17.6岁[(11.8±3.0)岁],回顾了1年的随访数据。所有患儿的实验室指标均得到了改善,但是严格SCD的患儿体质量稍有下降。作者认为由于SCD过于严格,儿童很难长时间坚持,对体质量的增长有一定影响。如果允许少量进食非SCD外的食物,并不会改变SCD的正面作用,因此,自由一点的SCD可能更加现实,也利于SCD的执行,提高依从性和推广。
2014年Cohen等[18]报道了第一个前瞻性单中心研究,评估了SCD在儿童CD患儿中的改善临床症状和促进黏膜愈合的有效性。研究纳入对象为活动性CD患儿(PCDAI≥15分)(包括初发和复发患儿),使用药物治疗+SCD进行治疗,总体随访时间为52周。在第12周和第52周随访时,分别采用胶囊内镜了解小肠黏膜愈合情况。10例CD患儿纳入,其中9例完成了最初12周的试验,临床缓解率为60%。Harvey Bradshaw (HB)、Lewis score(LS)和PCDAI均得到了明显降低。7例患儿完成了52周的治疗,其中6例患儿持续缓解,没有患儿换药或调整剂量,2例患儿得到了持续的黏膜愈合。最开始由于需要限制多种碳水化合物,所以比较难以找到提供合适的提供热量的替代品,但是最后都能够克服,并进行比较严格的饮食限制。大多数的患儿在12周随访时体质量得到了增加,可能与临床症状的改善和食欲增加有关。而近期的一项回顾性研究却不认同SCD对于黏膜愈合的促进作用。研究中纳入粪便钙卫蛋白轻度增高的CD患者仅使用SCD作为唯一的治疗手段,发现无患者出现完全的黏膜愈合,临床正常和实验室指标的改善也不能反映黏膜愈合[19]。目前报道的研究均为观察性研究,未设立对照组,且样本量小,本身在设计中也存在一定缺陷,因此,证明SCD到底能否提供比临床改善更加深度的益处,其力度仍然有限。但是,学者也提出,相对于将黏膜愈合作为SCD的治疗目标,饮食疗法对于儿童应该更关注社会和心理效益,更多地权衡对于患儿和家庭所带来利弊[20]。
3 总结和展望
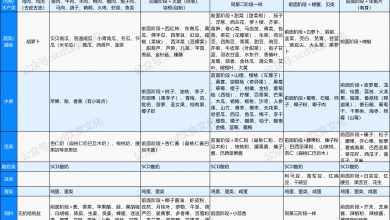
饮食不仅在IBD发病中作为关键的环境因素起作用,在IBD的诱导缓解和维持缓解中同样重要,是值得大力提倡的新的治疗手段[21,22,23,24]。对于发展中或不发达国家,探索饮食疗法的意义在于减少肠内营养治疗的疾病经济负担、降低复发及提高IBD治疗的医从性。将饮食作为治疗手段的研究有3种模式:补充、去除和替代[25]。SCD是作为一种新的饮食模式替代日常饮食。虽然目前SCD对IBD的作用在一些小样本量的临床研究中提示能够改善临床症状及实验室指标,但还需要大样本量的前瞻性多中心临床研究加以证实。同时,SCD中对于碳水化合物摄入的限制,也为指导IBD患儿的饮食提供了参考。但是SCD的具体执行需要根据地区饮食习惯和常见食品进行食谱设计,西方的SCD食谱(表1)并不一定适合东方的饮食习惯,成人食谱不一定适合儿童。同时,儿童IBD在使用SCD饮食的同时,应该考虑到生长发育的需求及饮食限制后对营养素的影响,是否需要在饮食之外进行额外营养物质的补充,还需要研究加以明确。总体来说,由于IBD治疗的长期性以及药物治疗的不良反应,大力发展和丰富营养治疗手段,对于树立家庭治疗IBD的信心和依从性具有重要意义。

炎症性肠病患者典型特殊碳水化合物饮食食谱举例[10]
扫描关注公众号,更多SCD资讯

参考文献
[1]SwaminathA, FeathersA, AnanthakrishnanAN,et al.Systematic review with meta-analysis:enteral nutrition therapy for the induction of remi-ssion in paediatric Crohn′s disease[J].Aliment Pharmacol Ther,2017,46(7):645-656.DOI:10.1111/apt.14253.
[2]PenaginiF, DililloD, BorsaniB,et al.Nutrition in pediatric inflammatory bowel disease:from etiology to treatment.A systematic review[J].Nutrients,2016,8(6):e334.DOI:10.3390/nu8060334.
[3]ConradMA, RoshJR.Pediatric inflammatory bowel disease[J].Pediatr Clin North Am,2017,64(3):577-591.DOI:10.1016/j.pcl.2017.01.005.
[4]RuemmeleFM, VeresG, KolhoKL,et al.Consensus guidelines of ECCO/ESPGHAN on the medical management of pediatric Crohn′s disease[J].J Crohns Colitis,2014,8(10):1179-1207.DOI:10.1016/j.crohns.2014.04.005.
[5]GottschallE.Breaking the Viscious Cycle[M].2nd ed.Baltimore,Ontario,Canada:Kirkton Press Limited,1994.
[6]DavidLA, MauriceCF, CarmodyRN,et al.Diet rapidly and reproducibly alters the human gut microbiome[J].Nature,2014,505(7484):559-563.DOI:10.1038/nature12820.
[7]SuskindDL, CohenSA, BrittnacherMJ,et al.Clinical and fecal microbial changes with diet therapy in active inflammatory bowel disease[J].J Clin Gastroenterol,2018,52(2):155-163.DOI:10.1097/MCG.0000000000000772.
[8]DubrovskyA, KittsCL.Effect of the specific carbohydrate Diet on the microbiome of a primary sclerosing cholangitis and ulcerative colitis patient[J].Cureus,2018,10(2):e2177.DOI:10.7759/cureus.2177.
[9]SusanK.The specific carbohydrate diet:can it really work?[J].Inflammat Bowel Dis,2014,20(Suppl 1):S27.DOI:10.1097/01.MIB.0000456771.55004.27.
[10]KhandalavalaBN, NirmalrajMC.Resolution of severe ulcerative colitis with the specific carbohydrate diet[J].Case Rep Gastroenterol,2015,9(2):291-295.DOI:10.1159/000438745.
[11]MccormickNM, LogomarsinoJV.The specific carbohydrate diet in the treatment of Crohn′s disease:a systematic review[J].J Gastroenterol Hepatol Res,2017,6(4):2392-2399.DOI:10.17554/j.issn.2224-3992.2017.06.688.
[12]HaasSV, HaasMP.The treatment of celiac disease with the specificcarbohydrate diet;report on 191 additional cases[J].Am J Gastroenterol,1955,(23):344-360.
[13]KakodkarS, FarooquiAJ, MikolaitisSL,et al.The specific carbohydrate diet for inflammatory bowel disease:a case series[J].J Acad Nutr Diet,2015,115(8):1226-1232.DOI:10.1016/j.jand.2015.04.016.
[14]ObihC, WahbehG, LeeD,et al.Specific carbohydrate diet for pediatric inflammatory bowel disease in clinical practice within an academic IBD center[J].Nutrition,2016,32(4):418-425.DOI:10.1016/j.nut.2015.08.025.
[15]SuskindDL, WahbehG, GregoryN,et al.Nutritional therapy in pediatric Crohn disease:the specific carbohydrate diet[J].J Pediatr Gastroenterol Nutr,2014,58(1):87-91.DOI:10.1097/MPG.0000000000000103.
[16]BralyK, WilliamsonN, ShafferML,et al.Nutritional adequacy of the specific carbohydrate diet in pediatric inflammatory bowel disease[J].J Pediatr Gastroenterol Nutr,2017,65(5):533-538.DOI:10.1097/MPG.0000000000001613.
[17]BurgisJC, NguyenK, ParkKT,et al.Response to strict and liberalized specific carbohydrate diet in pediatric Crohn′s disease[J].World J Gastroenterol,2016,22(6):2111-2117.DOI:10.3748/wjg.v22.i6.2111.
[18]CohenSA, GoldBD, OlivaS,et al.Clinical and mucosal improvement with the specific carbohydrate diet in pediatric Crohn′s disease[J].J Pediatr Gastroenterol Nutr,2014,59(4):516-521.DOI:10.1097/MPG.0000000000000449.
[19]WahbehGT, WardBT, LeeDY,et al.Lack of mucosal healing from modified specific carbohydrate Diet in pediatric patients with crohn disease[J].J Pediatr Gastroenterol Nutr,2017,65(3):289-292.DOI:10.1097/MPG.0000000-000001619.
[20]CohenSA.Alas,who and what can we trust? Patients,parents,surrogate markers,or the specific carbohydrate diet[J].J Pediatr Gastroenterol Nutr,2017,65(3):266-267.DOI:10.1097/MPG.000000000000-1665.
[21]HaskeyN, GibsonDL.An examination of diet for the maintenance of remission in inflammatory bowel disease[J].Nutrients,2017,9(3):e259.DOI:10.3390/nu9030259.
[22]ShivashankarR, LewisJD.The role of diet in inflammatory bowel disease[J].Curr Gastroenterol Rep,2017,19(5):22.DOI:10.1007/s11894-017-0563-z.
[23]LaneER, LeeD, SuskindDL.Dietary therapies in pediatric inflammatory bowel disease an evolving inflammatory bowel disease paradigm[J].Gastroenterol Clin North Am,2017,46(4):731-744.DOI:10.1016/j.gtc.2017.08.012.
[24]AleksandrovaK, Romero-MosqueraB, HernandezV.Diet,gut microbiome and epigenetics:emerging links with inflammatory bowel diseases and prospects for management and prevention[J].Nutrients,2017,9(9):e962.DOI:10.3390/nu9090962.
[25]LewisJD, AlbenbergL, LeeD,et al.The importance and challenges of dietary intervention trials for inflammatory bowel disease[J].Inflamm Bowel Dis,2017,23(2):181-191.DOI:10.1097/MIB.0000000-000001009.